Oferta
Popularne tagi
bydło, cielęta, indyki, konie, koty, kozy, kury, lekarze, lisy, norki, nowości, owce, psy, warchlaki, świnie WszystkieHydrocortisone aceponate Ecuphar
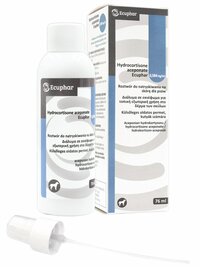
Hydrocortisone aceponate Ecuphar 0,584 mg/ml roztwór do natryskiwania na skórę dla psów
1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny:
Ecuphar NV
Legeweg 157-i
B-8020 Oostkamp
Belgia
Wytwórca odpowiedzialny za zwolnienie serii:
DIVASA-FARMAVIC, S.A.
Ctra. Sant Hipòlit, km 71
08503 Gurb-Vic, Barcelona
Hiszpania
2. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Hydrocortisone aceponate Ecuphar 0,584 mg/ml roztwór do natryskiwania na skórę dla psów
aceponian hydrokortyzonu
3. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
Aceponian hydrokortyzonu 0,584 mg/ml
Przezroczysty, bezbarwny lub lekko żółtawy roztwór.
4. WSKAZANIA LECZNICZE
Objawowe leczenie chorób skóry u psów przebiegających z objawami zapalenia i świądu.
Łagodzenie objawów klinicznych związanych z atopowym zapaleniem skóry u psów.
5. PRZECIWWSKAZANIA
Nie stosować na owrzodzoną skórę.
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
6. DZIAŁANIA NIEPOŻĄDANE
W bardzo rzadkich przypadkach w miejscu podania mogą pojawić się takie krótkotrwałe objawy, jak rumień i/lub świąd.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
- bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
- często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
- niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
- rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
- bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
W razie zaobserwowania działań niepożądanych również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
7. DOCELOWE GATUNKI ZWIERZĄT
Psy
8. DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
Natryskiwanie na skórę.
Przed pierwszym użyciem przekręcić dźwignię urządzenia rozpylającego na butelce.
Produkt leczniczy weterynaryjny jest aplikowany przez naciśnięcie dźwigni rozpylacza. Rozpylać z odległości 10 cm od leczonej powierzchni skóry.
Dawka zalecana wynosi 1,52 μg aceponianu hydrokortyzonu na cm2 leczonej powierzchni skóry na dzień i jest uwalniana przez dwukrotne naciśnięcie dźwigni rozpylacza, co odpowiada leczonej powierzchni skóry o wymiarach 10 cm x 10 cm.
- Leczenie chorób skóry u psów przebiegających z objawami zapalenia i świądu, leczenie należy kontynuować przez 7 kolejnych dni.
W przypadku konieczności przedłużenia leczenia, decyzja o dalszym stosowaniu produktu powinna być podjęta przez prowadzącego lekarza weterynarii w oparciu o ocenę bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Jeśli w ciągu 7 dni nie zostanie uzyskana poprawa, decyzję o dalszym leczeniu podejmuje lekarz weterynarii.
- Łagodzenie objawów klinicznych związanych z atopowym zapaleniem skóry u psów, leczenie należy kontynuować przez przynajmniej 14 i do 28 kolejnych dni.
Kontrolne badanie powinno zostać przeprowadzone przez lekarza weterynarii w 14. dniu aby zdecydować, czy konieczne jest dalsze leczenie. Pies powinien być regularnie poddawany kolejnym badaniom pod kątem supresji osi podwzgórze-przysadka-nadnercza (HPA) lub atrofii skóry, przy czym mogą one przebiegać bezobjawowo.
Jakiekolwiek długotrwałe stosowanie tego produktu w celu zwalczenia atopii powinno odbywać się po dokonaniu przez prowadzącego lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu. Powinno to nastąpić po ponownej weryfikacji diagnozy, a także po rozważeniu multimodalnego planu leczenia u danego zwierzęcia.
9. ZALECENIA DLA PRAWIDŁOWEGO PODANIA
Zaleca się stosowanie produktu w pomieszczeniach dobrze wentylowanych.
Produkt łatwopalny!
Nie rozpylać w kierunku otwartego ognia, ani rozżarzonych materiałów. Nie palić papierosów podczas stosowania produktu.
Produkt w postaci lotnej, po rozpyleniu nie wymaga rozprowadzania ręką po powierzchni skóry.
10. OKRES(-Y) KARENCJI
Nie dotyczy.
11. SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie przechowywać w temperaturze powyżej 25°C.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na etykiecie. Termin ważności oznacza ostatni dzień danego miesiąca.
Okres przechowywania po pierwszym otwarciu pojemnika: 6 miesięcy.
12. SPECJALNE OSTRZEŻENIA
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Kliniczne objawy atopowego zapalenia skóry, takie jak świąd i zapalenie skóry, nie są specyficzne dla tej choroby, dlatego przed rozpoczęciem leczenia należy wykluczyć inne przyczyny zapalenia skóry, takie jak zarażenia pasożytami zewnętrznymi i zakażenia wywołujące objawy dermatologiczne, a także zbadać przyczyny leżące u ich podstaw.
W przypadku współistniejącej choroby bakteryjnej lub zarażenia pasożytami, u psa należy zastosować odpowiednie leczenie.
W przypadku braku szczegółowych informacji, stosowanie u zwierząt cierpiących na zespół Cushinga opiera się o ocenę bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Ponieważ wiadomo, że glikokortykosteroidy spowalniają wzrost, stosowanie ich u młodych zwierząt (w wieku poniżej 7 miesięcy) opiera się o ocenę bilansu korzyści/ryzyka wynikającego ze stosowania produktu oraz o regularne badanie kliniczne.
Leczona powierzchnia ciała nie powinna być większa niż około 1/3 tej powierzchni psa odpowiadająca na przykład leczeniu dwóch boków ciała od kręgosłupa do linii gruczołu mlekowego, włączając okolicę barkową i pośladkową. Patrz także punkt „Przedawkowanie”. W innym przypadku postępować w oparciu o dokonaną przez prowadzącego lekarza weterynarii ocenę bilansu korzyści/ryzyka wynikającego ze stosowania produktu i poddawać psa regularnym badaniom klinicznym jak opisano w punkcie „Dawkowanie dla każdego gatunku, droga i sposób podania”.
Należy unikać rozpryskiwania w oczy zwierzęcia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Substancja czynna jest potencjalnie farmakologicznie czynna przy ekspozycji na wysokie dawki.
Produkt może powodować podrażnienie oczu po przypadkowym z nimi kontakcie.
Produkt jest łatwopalny.
Po użyciu umyć ręce. Unikać kontaktu z oczami.
Aby uniknąć kontaktu ze skórą, niedawno leczone zwierzęta nie powinny być dotykane, dopóki miejsce podania produktu nie wyschnie.
Rozpylać w dobrze wentylowanych pomieszczeniach. Aby uniknąć wdychania produktu, należy stosować spray w dobrze wentylowanym miejscu.
Nie rozpylać nad otwartym płomieniem lub żarzącym się materiałem.
Nie palić papierosów podczas pracy z produktem leczniczym weterynaryjnym.
Bezpośrednio po użyciu butelkę należy umieścić w opakowaniu zewnętrznym w bezpiecznym miejscu, niewidocznym i niedostępnym dla dzieci.
W razie przypadkowego kontaktu produktu ze skórą, należy unikać kontaktu ręce-usta i natychmiast przemyć wodą obszar skóry, który miał kontakt z produktem.
W przypadku kontaktu produktu z oczami, przemyć oczy obfitą ilością wody.
Jeśli podrażnienie oczu pozostaje, zwrócić się o pomoc lekarską.
Po przypadkowym spożyciu, szczególnie przez dzieci, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Inne ostrzeżenia
Rozpuszczalnik produktu może powodować trwałe zabrudzenie pewnych materiałów, w tym malowanych, lakierowanych lub innych powierzchni w domu czy mebli. Należy pozostawić do wyschnięcia miejsca, gdzie był stosowany produkt, zanim powoli się na kontakt z tymi materiałami.
Stosowanie w ciąży, laktacji lub w okresie nieśności
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i laktacji nie zostało określone. Wchłanianie ogólnoustrojowe jest nieznaczne. W przypadku stosowania produktu w dawkach zalecanych, działanie teratogenne oraz działanie toksyczne dla organizmu matki i płodu u psów jest mało prawdopodobne.
Należy stosować jedynie po dokonaniu przez prowadzącego lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
W związku z brakiem dostępnych informacji, nie zaleca się jednoczesnego stosowania produktu z innymi produktami do podawania miejscowego na te same partie uszkodzonej skóry.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki)
Badania tolerancji z zastosowaniem wielokrotnych dawek zostały ocenione w okresie 14 dni u zdrowych psów, przy zastosowaniu dawki będącej 3- i 5-krotnością zalecanej dawki, na powierzchnię ciała odpowiadającą powierzchni leżącej po obu stronach ciała w obszarze od kręgosłupa do linii gruczołu mlekowego, włączając okolicę barkową i pośladkową (1/3 powierzchni ciała psa).
Skutkowało to zmniejszoną zdolnością do wytwarzania kortyzolu, która jest całkowicie odwracalna w ciągu 7 do 9 tygodni od momentu zakończenia leczenia.
U 12 psów z atopowym zapaleniem skóry po miejscowym stosowaniu raz dziennie w zalecanej dawce terapeutycznej przez 28 do 70 (n = 2) kolejnych dni nie zaobserwowano zauważalnego wpływu na ogólnoustrojowe stężenie kortyzolu.
Główne niezgodności farmaceutyczne
Nieznane.
13. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii. Pomogą one chronić środowisko.
14. DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
Styczeń 2022
Szczegółowe informacje dotyczące powyższego produktu leczniczego weterynaryjnego są dostępne w witrynie internetowej Europejskiej Agencji Leków http://www.ema.europa.eu/.
15. INNE INFORMACJE
Badania radioaktywnej dystrybucji i dane farmakokinetyczne wskazują, iż aceponian hydrokortyzonu stosowany miejscowo ulega akumulacji i jest metabolizowany w skórze, co sprawia, że tylko nieznaczne ilości trafiają do krwiobiegu. Ta właściwość zwiększa stosunek pomiędzy pożądanym miejscowym działaniem przeciwzapalnym, a niekorzystnym działaniem ogólnoustrojowym.
Aceponian hydrokortyzonu stosowany zewnętrznie na zmiany skórne powoduje szybkie zmniejszenie zaczerwienienia, świądu oraz drapania, przy jednoczesnym ograniczeniu działania ogólnoustrojowego.
Biała butelka z poli(tereftalanu etylenu) (PET) z białą nakrętką z polipropylenu z kołnierzem uszczelniającym, oraz dołączoną pompką do spryskiwania. Pudełko tekturowe zawiera jedną butelkę o poj. 76 ml.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego.
Polska
ScanVet Poland Sp. z o.o.
ul. Kiszkowska 9
PL - 62-200 Gniezno
Tel: +48 614264920
scanvet@scanvet.pl
Pozwolenie nr EU/2/18/230/001