Oferta
Popularne tagi
bydło, cielęta, indyki, konie, koty, kozy, kury, lekarze, lisy, norki, nowości, owce, psy, warchlaki, świnie WszystkieOtisur
1. Nazwa weterynaryjnego produktu leczniczego
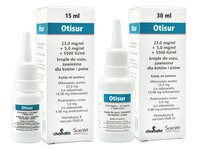
Otisur 23,0 mg/ml + 5,0 mg/ml + 5500 IU/ml krople do uszu, zawiesina dla kotów i psów
2. Skład
Każdy ml białej lub prawie białej zawiesiny zawiera:
Substancje czynne:
Mikonazolu azotan 23,0 mg (co odpowiada 19,98 mg mikonazolu)
Prednizolonu octan 5,0 mg (co odpowiada 4,48 mg prednizolonu)
Polimyksyny B siarczan 5500 IU
3. Docelowe gatunki zwierząt
Koty i psy
4. Wskazania lecznicze
Leczenie zapalenia ucha zewnętrznego i małych, miejscowych, powierzchownych zakażeń skóry wywołanych przez mieszane zakażenia następującymi bakteriami i grzybami wrażliwymi na mikonazol i polimyksynę B:
- Bakterie Gram-dodatnie: Staphylococcus spp. i Streptococcus spp.
- Bakterie Gram-ujemne: Pseudomonas spp. i Escherichia coli
- Grzyby: Malassezia pachydermatis, Candida spp., Microsporum spp. i Trichophyton spp.
Leczenie inwazji Otodectes cynotis (świerzbowców usznych) w przypadku jednoczesnego zakażenia bakteriami i grzybami wrażliwymi na polimyksynę B i mikonazol
5. Przeciwwskazania
Nie stosować:
- w przypadkach nadwrażliwości na substancje czynne weterynaryjnego produktu leczniczego, a także na inne kortykosteroidy, inne azolowe środki przeciwgrzybicze lub na dowolne substancje pomocnicze,
- w przypadkach zakażeń wirusowych skóry,
- w przypadkach rozległych zmian skórnych oraz słabo gojących się lub świeżych ran,
- u zwierząt z perforacją błony bębenkowej,
- u zwierząt, u których stwierdzono oporność patogenów na polimyksynę B i/lub mikonazol,
- na gruczoły sutkowe suk i kotek w okresie laktacji.
6. Specjalne ostrzeżenia
Specjalne ostrzeżenia:
Tylko do użytku zewnętrznego
Wykazano oporność krzyżową między polimyksyną B i kolistyną u E. coli. Stosowanie produktu należy dokładnie rozważyć, gdy badania lekowrażliwości wykazały oporność na polimyksyny, ponieważ jego skuteczność może być zmniejszona.
Stosowanie produktu powinno opierać się na identyfikacji i badaniu lekowrażliwości docelowych patogenów. Jeśli nie jest to możliwe, terapia powinna opierać się na danych epidemiologicznych i wiedzy na temat wrażliwości patogenów docelowych na poziomie lokalnym/regionalnym.
Stosowanie produktu powinno odbywać się zgodnie z oficjalną, krajową i regionalną polityką przeciwdrobnoustrojową.
W leczeniu pierwszego rzutu należy zastosować antybiotyk o niższym ryzyku selekcji oporności na środki przeciwdrobnoustrojowe (niższa kategoria AMEG), jeśli badanie lekowrażliwości sugeruje prawdopodobną skuteczność takiego rozwiązania.
Ta kombinacja przeciwdrobnoustrojowa powinna być stosowana tylko wtedy, gdy badania diagnostyczne wskazują na potrzebę równoczesnego podawania każdej z tych substancji czynnych.
Specjalne środki ostrożności dotyczące bezpiecznego stosowania u docelowych gatunków zwierząt:
W przypadku utrzymujących się inwazji Otodectes cynotis (świerzbowców usznych) należy rozważyć ogólnoustrojowe leczenie odpowiednim akarycydem.
Przed zastosowaniem produktu należy sprawdzić integralność błony bębenkowej.
Możliwe jest ogólnoustrojowe działanie kortykosteroidów, zwłaszcza gdy produkt jest stosowany pod opatrunkiem okluzyjnym, przy zwiększonym przepływie krwi w skórze lub jeśli produkt zostanie połknięty podczas lizania.
Należy unikać spożycia produktu przez leczone zwierzęta lub zwierzęta mające kontakt z leczonymi zwierzętami.
Należy unikać kontaktu produktu z oczami u zwierząt. W razie przypadkowego kontaktu dokładnie spłukać wodą.
Specjalne środki ostrożności dla osób podających weterynaryjny produkt leczniczy zwierzętom:
Osoby o znanej nadwrażliwości na prednizolon, polimyksynę B lub mikonazol powinny unikać kontaktu z weterynaryjnym produktem leczniczym, który może powodować podrażnienie skóry i oczu. Unikać kontaktu ze skórą lub oczami. Podczas podawania weterynaryjnego produktu leczniczego zwierzętom należy zawsze nosić jednorazowe rękawiczki. Po przypadkowym rozlaniu na skórę lub oczy należy je natychmiast przemyć dużą ilością wody. Po użyciu umyć ręce.
Należy zachować ostrożność, aby uniknąć przypadkowego połknięcia. W razie przypadkowego połknięcia należy niezwłocznie zasięgnąć porady lekarza i pokazać lekarzowi ulotkę lub etykietę.
Ciąża i laktacja:
Bezpieczeństwo weterynaryjnego produktu leczniczego stosowanego w czasie ciąży i laktacji nie zostało określone.
Wchłanianie mikonazolu, polimyksyny B i prednizolonu przez skórę jest niskie, u psów i kotów nie jest spodziewane wystąpienie działania teratogennego/embriotoksycznego/fetotoksycznego ani toksycznego dla samicy. Podczas pielęgnacji może nastąpić spożycie substancji czynnych przez leczone zwierzęta, więc można się spodziewać obecności substancji czynnych we krwi i mleku.
Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści do ryzyka wynikającego ze stosowania produktu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Brak dostępnych danych.
Przedawkowanie:
Nie jest spodziewane wystąpienie innych objawów niż wymienionych w punkcie 7.
Główne niezgodności farmaceutyczne:
Nieznane
7. Zdarzenia niepożądane
Docelowe gatunki zwierząt: koty i psy
Przedłużone i rozległe, miejscowe stosowanie produktów kortykosteroidowych powoduje lokalną immunosupresję (prowadzącą do określonych efektów miejscowych wyszczególnionych w tabeli, w tym również teleangiektazji) i ogólnoustrojowych - w tym zahamowania czynności kory nadnerczy.
Zgłaszanie zdarzeń niepożądanych jest istotne, ponieważ umożliwia ciągłe monitorowanie bezpieczeństwa stosowania weterynaryjnego produktu leczniczego. W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, w pierwszej kolejności poinformuj o tym lekarza weterynarii. Można również zgłosić działania niepożądane do podmiotu odpowiedzialnego lub lokalnego przedstawiciela podmiotu odpowiedzialnego przy użyciu danych kontaktowych zamieszczonych w końcowej części tej ulotki lub poprzez krajowy system zgłaszania:
Departament Oceny Dokumentacji i Monitorowania Niepożądanych Działań Produktów Leczniczych Weterynaryjnych Urzędu Rejestracji Produktów Leczniczych, Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181, PL-02-222 Warszawa, Tel.: +48 22 49-21-687, Faks: +48 22 49-21-605, Strona internetowa: https://smz.ezdrowie.gov.pl
8. Dawkowanie dla każdego gatunku, drogi i sposób podania
Podanie do ucha i podanie na skórę
Na początku leczenia włosy otaczające lub zakrywające zmiany należy przyciąć; czynność tą należy powtórzyć podczas leczenia, jeśli to konieczne.
Infekcje zewnętrznego przewodu słuchowego (otitis externa):
Oczyścić zewnętrzny przewód słuchowy oraz małżowinę uszną i podać 5 kropli produktu leczniczego weterynaryjnego do zewnętrznego przewodu słuchowego dwa razy dziennie.
Rozmasować dokładnie ucho i przewód słuchowy, aby zapewnić prawidłowe rozprowadzenie substancji czynnych, ale na tyle delikatnie, aby uniknąć wystąpienia bólu u zwierzęcia.
Leczenie należy kontynuować bez przerw przez kilka dni po całkowitym ustąpieniu objawów klinicznych, co najmniej przez 7 10 dni do 14 dni. Powodzenie leczenia powinno zostać zweryfikowane przez lekarza weterynarii przed przerwaniem leczenia.
Infekcje skórne (niewielkie miejscowe powierzchowne): nanieść kilka kropli produktu leczniczego weterynaryjnego na leczone zmiany skórne dwa razy dziennie i dokładnie wetrzeć. Leczenie należy kontynuować bez przerw do kilku dni po całkowitym ustąpieniu objawów klinicznych, do 14 dni.
W niektórych uporczywych przypadkach (zakażenia ucha lub skóry) konieczne może być kontynuowanie leczenia przez 2 do 3 tygodni. W przypadkach, gdy konieczne jest przedłużone leczenie, wymagane są powtórne badania kliniczne, w tym ponowna ocena diagnozy.
9. Zalecenia dla prawidłowego podania
Energicznie potrząsać butelką przez 10 do 15 sekund, aby upewnić się, że produkt przed użyciem został całkowicie wymieszany. Należy bezwzględnie unikać jakiegokolwiek zanieczyszczenia zakraplacza.
10. Okresy karencji
Nie dotyczy
11. Specjalne środki ostrożności podczas przechowywania
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie przechowywać w temperaturze powyżej 25°C.
Przechowywać pojemnik w opakowaniu zewnętrznym w celu ochrony przed światłem.
Nie przechowywać w lodówce ani nie zamrażać.
Po otwarciu zużyć w ciągu trzech miesięcy. Wyrzucić niewykorzystany materiał.
Nie używać tego weterynaryjnego produktu leczniczego po upływie terminu ważności podanego na etykiecie i pudełku tekturowym. Termin ważności oznacza ostatni dzień danego miesiąca.
Po pierwszym przekłuciu (otwarciu) pojemnika, ustalić, z uwzględnieniem terminu ważności podanego powyżej, datę kiedy pozostały w pudełku produkt należy wyrzucić. Tę datę usunięcia należy wpisać w odpowiednim miejscu.
12. Specjalne środki ostrożności dotyczące usuwania
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
Należy skorzystać krajowego systemu odbioru odpadów w celu usunięcia niewykorzystanego weterynaryjnego produktu leczniczego lub materiałów odpadowych pochodzących z jego zastosowania w sposób zgodny z obowiązującymi przepisami oraz właściwymi krajowymi systemami odbioru odpadów.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii.
13. Klasyfikacja weterynaryjnych produktów leczniczych
Weterynaryjny produkt leczniczy wydawany na receptę weterynaryjną.
14. Numery pozwolenia na dopuszczenie do obrotu i wielkości opakowań
Nr pozwolenia: 3236/23
15 ml lub 30 ml butelka z zakraplaczem.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
15. Data ostatniej aktualizacji ulotki informacyjnej
20/01/2023
Szczegółowe informacje dotyczące powyższego weterynaryjnego produktu leczniczego są dostępne w unijnej bazie danych produktów.
16. Dane kontaktowe
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii oraz dane kontaktowe do zgłaszania podejrzeń działań niepożądanych:
Chanelle Pharmaceuticals Manufacturing Ltd,
Loughrea,
Co. Galway,
Irlandia
Tel. +353 (0)91 841788
reception@chanellegroup.ie
Lokalni przedstawiciele oraz dane kontaktowe do zgłaszania podejrzeń działań niepożądanych:
ScanVet Poland Sp. z o.o.
Skiereszewo, ul. Kiszkowska 9
62-200 Gniezno
Tel. +48 614264920
pharmacovigilance@scanvet.pl