Oferta
Popularne tagi
bydło, cielęta, indyki, konie, koty, kozy, kury, lekarze, lisy, norki, nowości, owce, psy, warchlaki, świnie WszystkieMetrocare 500 mg tabletki dla psów i kotów
1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny
Ecuphar NV
Legeweg 157-i
B-8020 Oostkamp
Belgia
Wytwórca odpowiedzialny za zwolnienie serii:
Lelypharma B.V.
Zuiveringsweg 42
8243 PZ Lelystad
Holandia
2. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Metrocare 500 mg tabletki dla psów i kotów
Metronidazol
3. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
Każda tabletka zawiera:
Substancja czynna: Metronidazol 500 mg
Okrągła, wypukła tabletka w kolorze białym lub białawym, z linią podziału w kształcie krzyżyka z jednej strony.
Tabletki można podzielić na 2 lub 4 równe części.
4. WSKAZANIA LECZNICZE
Leczenie zakażeń układu pokarmowego wywołanych przez Giardia spp. i Clostridia spp. (tj. C. perfringens lub C. difficile).
Leczenie zakażeń układu moczowo-płciowego, jamy ustnej, gardła i skóry, wywołanych bakteriami bezwzględnie beztlenowymi (np. Clostridia spp.), wrażliwymi na metronidazol.
5. PRZECIWWSKAZANIA
Nie stosować w przypadku zaburzeń funkcji wątroby.
Nie stosować w przypadku nadwrażliwości na substancję czynną lub którąkolwiek z substancji pomocniczych.
6. DZIAŁANIA NIEPOŻĄDANE
Po podaniu metronidazolu mogą wystąpić następujące działania niepożądane:
wymioty, hepatotoksyczność, neutropenia oraz objawy neurologiczne.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
- bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
- często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
- niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
- rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
- bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii. Można również zgłosić działania niepożądane poprzez krajowy system raportowania (www.urpl.gov.pl)
7. DOCELOWE GATUNKI ZWIERZĄT
Psy i koty.
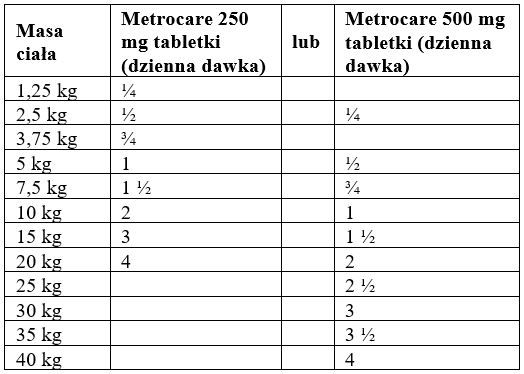
8. DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
Podanie doustne.
Zalecana dawka wynosi 50 mg metronidazolu na kg masy ciała dziennie, przez 5 - 7 dni. Dzienną dawkę można podzielić na połowę w celu podania leku dwa razy dziennie (tj. 25 mg/kg masy ciała dwa razy dziennie).
Aby zagwarantować podanie prawidłowej dawki, masę ciała należy określić tak dokładnie, jak to możliwe.
Tabletki można podzielić na 2 lub 4 równe części, aby zapewnić podanie dokładnie odmierzonej dawki. Tabletkę należy w tym celu umieścić na płaskiej powierzchni, z krzyżykiem linii podziału do góry a wypukłą (zaokrągloną) stroną tabletki do dołu.
Połówki: nacisnąć kciukiem lub dwoma dowolnymi palcami na boczne krawędzie tabletki.
Ćwiartki: nacisnąć kciukiem lub dowolnym palcem środek tabletki.
Pozostała część(i) powinna(y) zostać wykorzystane przy następnym podaniu(ach).
9. ZALECENIA DLA PRAWIDŁOWEGO PODANIA
Brak
10. OKRES(-Y) KARENCJI
Nie dotyczy.
11. SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Podzielone tabletki należy umieścić z powrotem w blistrze i przechowywać chroniąc przed światłem.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na blistrze i opakowaniu tekturowym.
12. SPECJALNE OSTRZEŻENIA
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
Brak
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Z uwagi na prawdopodobną zmienność (czasową, geograficzną) w występowaniu bakterii odpornych na metronidazol, zaleca się pobranie próbek bakteriologicznych i oznaczenie lekowrażliwości.
O ile tylko będzie to możliwe, produkt powinien być stosowany wyłącznie w oparciu o oznaczenie lekowrażliwości.
Podczas stosowania produktu leczniczego weterynaryjnego należy uwzględnić obowiązujące krajowe i regionalne wytyczne w zakresie przeciwdziałania zjawisku antybiotykooporności.
W bardzo rzadkich przypadkach, zwłaszcza w następstwie przedłużonego leczenia metronidazolem, mogą wystąpić objawy neurologiczne.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Metronidazol wykazuje potwierdzone właściwości mutagenne i genotoksyczne, obserwowane u zwierząt laboratoryjnych i ludzi. Metronidazol ma również potwierdzone działanie rakotwórcze obserwowane u zwierząt laboratoryjnych, oraz możliwe działanie rakotwórcze na organizm ludzki. Niemniej, nie ma wystarczających dowodów potwierdzających rakotwórcze działanie metronidazolu u ludzi.
Metronidazol może być szkodliwy dla nienarodzonego dziecka.
Podczas stosowania produktu należy używać nieprzepuszczalnych rękawic, aby uniknąć kontaktu produktu ze skórą oraz zapobiec przeniesieniu z rąk do ust.
W celu uniknięcia przypadkowego spożycia, zwłaszcza przez dziecko, niewykorzystane części tabletek należy umieścić w otwartym gnieździe blistra, a następnie włożyć blister z powrotem do opakowania zewnętrznego, które należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. W razie przypadkowego spożycia, należy niezwłocznie zasięgnąć porady lekarskiej, pokazując lekarzowi ulotkę lub etykietę produktu. Po operowaniu tabletkami należy dokładnie umyć ręce.
Metronidazol może powodować reakcje nadwrażliwości. W przypadku znanej nadwrażliwości na metronidazol należy unikać kontaktu z produktem leczniczym weterynaryjnym.
Ciąża i laktacja:
W badaniach na zwierzętach laboratoryjnych uzyskano niejednolite wyniki w odniesieniu do działania metronidazolu na zarodki i w trakcie ciąży. Z związku z tym, stosowanie produktu w okresie ciąży jest niewskazane. Metronidazol jest wydalany do mleka matki, stąd też nie zaleca się stosowania produktu w okresie laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Metronidazol może hamować metabolizm innych leków, takich jak fenytoina, cyklosporyna i warfaryna w wątrobie.
Cymetydyna może spowolnić metabolizm metronidazolu w wątrobie, skutkując zwiększonym stężeniem metronidazolu w surowicy.
Fenobarbital może przyspieszać metabolizm metronidazolu w wątrobie, skutkując obniżonym stężeniem metronidazolu w surowicy.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki):
Prawdopodobieństwo wystąpienia działań niepożądanych wzrasta w przypadku dawkowania i okresu leczenia przekraczających zalecany schemat leczenia. W przypadku wystąpienia objawów neurologicznych należy przerwać leczenie, i leczyć pacjenta objawowo.
Główne niezgodności farmaceutyczne:
Nie dotyczy.
13. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
14. DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
16/07/2020
15. INNE INFORMACJE
Pudełko tekturowe zawierające 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25 lub 50 blistrów po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Lokalny przedstawiciel podmiotu odpowiedzialnego:
ScanVet Poland Sp. z o.o.
ul. Kiszkowska 9
62-200 Gniezno
Tel: +48 614264920
scanvet@scanvet.pl
Pozwolenie nr 2996/20