Offer
Popular tags
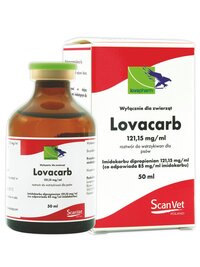
bydło, cielęta, indyki, konie, koty, kozy, kury, lekarze, lisy, norki, nowości, owce, psy, warchlaki, świnie AllLovacarb 121,15 mg/ml, roztwór do wstrzykiwań dla psów
1. NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY
ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny:
Lovapharm Consulting B.V. Rijsven 3 5645 KH Eindhoven Holandia
Wytwórca odpowiedzialny za zwolnienie serii:
Interchemie werken “De Adelaar” Eesti AS Vanapere tee 14, Püünsi village, Viimsi rural municipality Harjumaa county 74013 Estonia
lub
Interchemie werken “De Adelaar” B.V. Metaalweg 8 5804 CG Venray Holandia
2. NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Lovacarb 121,15 mg/ml, roztwór do wstrzykiwań dla psów
3. ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
Substancja czynna: Imidokarbu dipropionian 121,15 mg/ml (co odpowiada 85 mg/ml imidokarbu)
4. WSKAZANIA LECZNICZE
Lek przeznaczony jest do stosowania u psów w zapobieganiu i leczeniu inwazji Babesia canis.
5. PRZECIWWSKAZANIA
Nie podawać dożylnie. Lek stosuje się w dawce jednorazowej, nie podawać powtórnie. Nie stosować w przypadku nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
6. DZIAŁANIA NIEPOŻĄDANE
Po podaniu leku mogą być obserwowane objawy związane z pobudzeniem układu przywspółczulnego. Nasilenie objawów niepożądanych można zmniejszyć podając atropinę.
W miejscu iniekcji może wystąpić obrzęk i bolesność.
Obserwowano zejścia śmiertelne w wyniku reakcji anafilaktycznych.
O wystąpieniu działań niepożądanych po podaniu tego produktu lub zaobserwowaniu jakichkolwiek niepokojących objawów nie wymienionych w ulotce (w tym również objawów u człowieka na skutek kontaktu z lekiem), należy powiadomić właściwego lekarza weterynarii, podmiot odpowiedzialny lub Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Formularz zgłoszeniowy należy pobrać ze strony internetowej http://www.urpl.gov.pl (Pion Produktów Leczniczych Weterynaryjnych)
7. DOCELOWE GATUNKI ZWIERZĄT
Pies
8. DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
Podanie podskórne
Podawać jednorazowo w dawkach:
Leczniczo: 0,25-0,50 ml produktu na 10 kg m.c. (3-6 mg imidokarbu dipropionianu na 1 kg m.c.).
Zapobiegawczo: 0,50 ml produktu na 10 kg m.c. (6 mg imidokarbu dipropionianu na 1 kg m.c.).
W przypadku stosowania zapobiegawczego jednorazowe podanie produktu chroni psa przed inwazją B. canis przez okres 2-4 tygodni.
9. ZALECENIA DLA PRAWIDŁOWEGO PODANIA
Gumowy korek można bezpiecznie przekłuwać do 15 razy.
Używać strzykawek pozwalających na dawkowanie z dokładnością do 0,1 ml.
W celu zapewnienia właściwego dawkowania należy określić masę ciała najdokładniej jak to tylko możliwe.
10. OKRES(-Y) KARENCJI
Nie dotyczy.
11. SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Przechowywać w temperaturze poniżej 30°C.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
12. SPECJALNE OSTRZEŻENIA
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Ze względu na potencjalną toksyczność substancji czynnej (hepatotoksyczność i nefrotoksyczność) nie przekraczać zalecanych dawek. Należy zachować szczególną ostrożność podczas stosowania u psów chorych na cukrzycę lub ze stanami hipoglikemicznymi. U psów z zaburzoną czynnością płuc, wątroby i nerek produkt stosować wyłącznie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści do ryzyka wynikającego ze stosowania produktu.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Leku nie mogą podawać osoby, które zgodnie z zaleceniami lekarza powinny unikać kontaktu z inhibitorami acetylocholinoesterazy. W razie wystąpienia objawów związanych z pobudzeniem układu przywspółczulnego należy bezzwłocznie skontaktować się z lekarzem. Należy unikać kontaktu leku ze skórą i spojówkami. W przypadku kontaktu natychmiast spłukać pozostałości leku bieżącą wodą.
Ciąża i laktacja:
Brak jest przeciwwskazań do stosowania leku w zalecanych dawkach w okresie ciąży i laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Nie podawać razem z inhibitorami acetylocholinoesterazy.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki):
U psów nie obserwowano działania toksycznego leku podawanego w dawce do 7 mg/kg. Może dojść do śmierci w przypadku podania dawki pięciokrotnie wyższej od zalecanej dawki terapeutycznej lub w przypadku podania wyższych dawek. Objawy odpowiadające pobudzeniu cholinergicznemu należy leczyć z zastosowaniem siarczanu atropiny. Objawy te mogą wystąpić już przy stosowaniu zalecanych dawek terapeutycznych.
Główne niezgodności farmaceutyczne:
Ponieważ nie wykonywano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
13. SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH ZNIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci. O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii. Pomogą one chronić środowisko.
14. DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
2020-06-22
15. INNE INFORMACJE
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
ScanVet Poland Sp. z o.o. Skiereszewo ul. Kiszkowska 9
62-200 Gniezno, Polska